6978356d51c71
Ожиріння є хронічним захворюванням багатофакторного походження та може бути визначене як стан надмірного накопичення жиру в організмі. Ожиріння у людини є наслідком не лише надмірного споживання насичених жирів, а й складної комбінації безлічі факторів, пов'язаних із харчуванням та способом життя, безпосередньо пов'язаних із збільшенням споживання продукції промислового виробництва (Cordain et al., 2005). Ожиріння стало значною проблемою у сфері охорони здоров'я в західних країнах, будучи основним фактором розвитку метаболічного синдрому (Furukawa et al., 2017).
Метаболічний синдром поєднує багатофакторні проблеми зі здоров'ям, такі як непереносимість глюкози, «центральне» ожиріння, дисліпідемія і резистентність до інсуліну, і часто пов'язаний з артеріальною гіпертензією. Ці захворювання підвищують ризик розвитку низки патологій, особливо серцево-судинних захворювань та діабету 2-го типу (Carillon et al., 2016).
Ожиріння саме по собі індукує системний окислювальний стрес за рахунок підвищення рівня НАДФН-оксидази та зниження рівня антиоксидантних ферментів, що викликає порушення регуляції продукції адипоцитокінів, і цей підвищений окислювальний стрес у накопиченому жирі є, принаймні частково, основною причиною порушення регуляції адипоцитокінів та розвитку метаболічного синдрому (Furukawa et al., 2017)
Збільшення продукції АФК із накопиченого жиру також призводить до посилення окислювального стресу в крові, небезпечно впливаючи на інші органи, включаючи печінку, скелетні м'язи та аорту (див. мал.).
6978356d526ed

Робоча модель, яка ілюструє, як збільшення продукції АФК у накопиченому жирі сприяє розвитку метаболічного синдрому (Furukawa et al., 2017).
6978356d5316d
Нещодавно було висловлено припущення, що підвищений рівень окислювального стресу у накопиченому жирі є першою ознакою захворювання і однією з важливих основних причин розвитку порушення ендотеліальної функції і метаболічного синдрому, пов'язаного з ожирінням. Отже, редокс-стан жирової тканини є безпосередньою мішенню для визначення нових методів лікування метаболічного синдрому, пов'язаного з ожирінням, що було продемонстровано у моделі миші in vivo (Youn et al., 2014; Furukawa et al., 2017).
Було вивчено вплив СОД на моделі ожиріння (Carillon et al., 2013a; Carillon et al., 2014a). В результаті прийому СОД спостерігалося сприятливе збільшення ендогенних захисних антиоксидантних ферментів (СОД, КП та КАТ) у печінці та жировій тканині хом'яків з ожирінням (Carillon et al., 2013a; Carillon et al., 2014a). Крім того, СОД знижувала масу тіла та маркери ожиріння. Автори повідомили про зниження маси тіла на 5% у хом'яків з ожирінням, яким перорально додавали СОД (10 МО/добу протягом 28 днів; що відповідає дозі для людини: 400 МО/добу) порівняно з тваринами з ожирінням, яким лікування не проводили (група CAF, тільки група, яка споживала кафетерій-дієту), (див. Таблицю 1). Кафетерій-дієта призвела до підвищення рівня тригліцеридів, холестерину ЛНЩ, глюкози та лептину у плазмі крові. Лікування СОД коригувало процес підвищення рівня холестерину ЛНЩ та глюкози на 55 і 35%, відповідно (див. Таблицю).
6978356d53730
| STD | CAF | СОД | |
|---|---|---|---|
| Збільшення маси тіла через 15 тижнів (г) | 34±2a | 109±3b | - |
| Кінцева маса тіла (г) | 107±2a | 190±2b | 183±2c |
| Тригліцериди (г/л) | 0,58±0,06a | 1,20±0,35b | 1,59±0,21b |
| Холестерин (г/л) | 1,22±0,04a | 1,59±0,11b | 1,31±0,05a |
| Холестерин ЛВЩ (г/л) | 1,04±0,04a | 1,10±0,08a | 1,08±0,05a |
| Холестерин ЛНЩ (г/л) | 0,18±0,04a | 0,49±0,06b | 0,23±0,01a |
| Глюкоза (г/л) | 2,00±0,11a | 2,88±0,23b | 1,87±0,18a |
| Лептин (г/л) | 0,036±0,010a | 0,902±0,236b | 0,755±0,173b |
| Адипонектин (г/л) | 224±7a | 146±9b | 178±28b |
| Інсулін (мкг/л) | 1,07±0,11a | 5,10±0,58b | 3,85±0,55c |
| Маса жирової тканини/довжина великогомілкової кістки (г/см) | 1,50±0,1a | 6,30±0,3b | 4,90±0,1c |
| Кількість адипоцитів (умовні/одиниці) | 249±17a | 596±144b | 483±115b |
Таблиця 1. Маркери ожиріння та метаболічного синдрому. Значення є середніми значеннями ± SEM. Середні значення в рядку з верхніми індексами без загальної літери відрізняються знаним чином, p< 0,05 (за даними Carillon et al., 2014b).
Кафетерій-дієта викликала гіперплазію і гіпертрофію адипоцитів в абдомінальній ділянці. Розмір адипоцитів значно зменшився на 54%, а маса жирової тканини значно зменшилася на 22% після прийому СОД (Carillon et al., 2014b). Лікування СОД підвищувало експресію СОД, ГП і КАТ порівняно з тваринами з ожирінням, яким лікування не проводили, як у печінці, так і в жировій тканині (Carillon et al., 2014b).
Профілактика неалкогольного стеатогепатиту (НАСГ) була показана після 2-3 місяців перорального введення СОД хом’якам з ожирінням, спричиненим дієтою, за рахунок зниження маси тіла, абдомінального жиру, тригліцеридемії, інсулінемії, резистентності до інсуліну і ліпідів печінки, а також запобігання дисбалансу адипокінів (Decorde et al., 2009). НАСГ – це поширена форма жирової хвороби печінки, що розвинулася за відсутності зловживання алкоголю в анамнезі, яка може прогресувати до рубцювання печінки з подальшим цирозом (McClain et al., 2004). Загалом у хом'яків, які отримували добавки, спостерігалося значне зниження маси тіла (8,3%). Добавка СОД також викликала значне зниження рівня ліпідів у печінці (73%) та повністю запобігала стеатогепатиту, викликаному споживанням продуктів з високим вмістом жирів (Decorde et al., 2009).
6978356d5418e

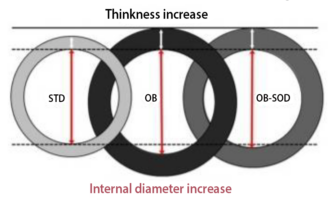
Інше дослідження розширює переваги добавки СОД при ожирінні на рівні судин. Добавка СОД кардинально змінила тенденцію збільшення внутрішнього діаметра, спричиненого кафетерій-дієтою (див. Рис. 7) (Carillon et al., 2016).
6978356d55887
Щоденне вживання TetraSOD® допомагає людям з ожирінням:
Page Copyright
© Copyright 2024 Kleemed Ukraine LLC - All rights reserved.
