69783604a27b4

Хвороба Альцгеймера (ХА) характеризується прогресуючим зниженням розумових функцій, що може бути пов'язане зі значним зменшенням об’єму головного мозку у пацієнтів з ХА порівняно зі здоровими пацієнтами (Cheignon et al., 2018). Ця атрофія виникає в результаті дегенерації синапсів та загибелі нейронів, зокрема, в гіпокампі, підкірковій структурі мозку, що відіграє важливу роль у пам’яті, навчанні та просторовій орієнтації. На сьогоднішній день не існує ефективних методів лікування, і діагностика, як і раніше, залишається проблемою, яка часто підтверджується тільки після смерті (Kaplan et al., 2013; Soto- Rojas et al., 2015).
Згідно з Всесвітнім звітом про проблеми хвороби Альцгеймера у 2015 році у всьому світі налічувалося понад 46,8 мільйонів осіб з деменцією; очікується, що це число майже подвоюватиметься кожні 20 років.
69783604a4435
Відомо, що окислювальний стрес відіграє важливу роль у патогенезі хронічних нейродегенеративних захворювань, таких як ХА, хвороба Паркінсона або боковий аміотрофічний склероз, для всіх характерна виборча загибель нейронів і накопичення нерозчинних білкових відкладень (Cheignon et al., 2018).
При ХА повідомлялось про опосередковане АФК ураження (Pratico, 2008). У низці досліджень було виявлено підвищений рівень окисного ушкодження біомолекул, включаючи протеїни, ліпіди, вуглеводи та нуклеїнові кислоти (Moreira et al., 2008; Fukuda et al., 2009; Sultana et al., 2011). Крім того, було виявлено зміну рівнів антиоксидантних ферментів у деяких частинах мозку при ХА (Sultana et al., 2011). Таким чином, окислювальний стрес відіграє основну та центральну роль у загибелі нейронів при ХА (Nunomura et al., 2006). Отже, «гіпотеза окислювального стресу при ХА» стала ключовим фактором як розвитку, так і прогресування захворювання. Фактично окислювальний стрес є важливим нейродегенеративним елементом, який може сприяти загибелі нейронів, викликаючи апоптоз або некроз (див. мал.).
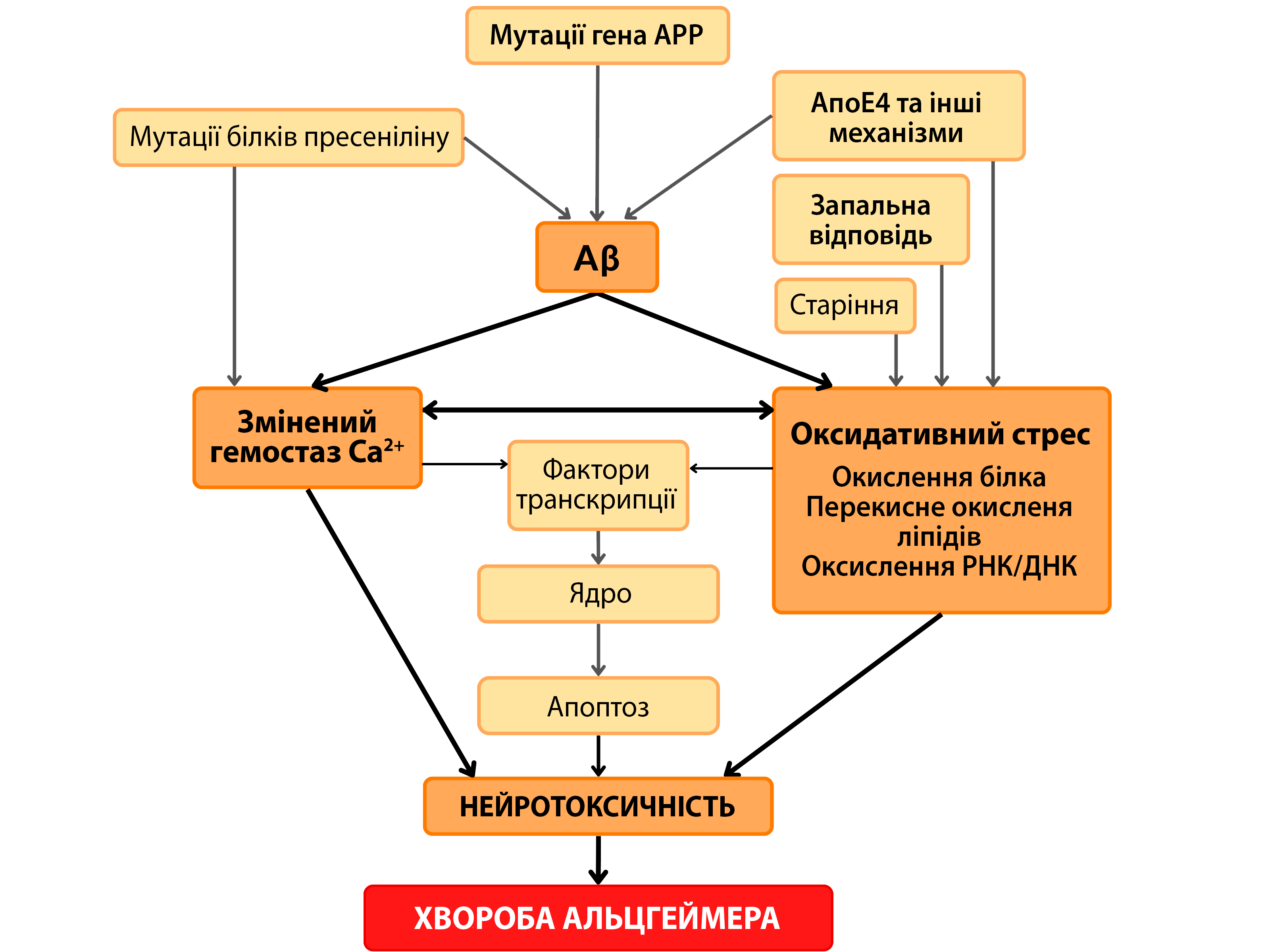
69783604a52d1
Повідомлялося, що дефіцит СОД у моделях тварин підвищував рівні Aβ, прискорював початок поведінкових змін, олігомеризацію Aβ та погіршення пам'яті, і що ці явища були переважно опосередковані окисним ушкодженням (Esposito et al., 2006). Рівні СОД в осіб з ХА також були значно знижені в порівнянні з особами того ж віку без ХА (Murakami et al., 2011).
Активність СОД запобігає апоптозу, індукованому Aβ, шляхом втручання в каспаза-3-опосередковані шляхи апоптозу. Це може бути пов'язано або з видаленням супероксиду, що блокує і запобігає пероксидативної активності Aβ, або з секвестрацією іонів міді, що також необхідно для прооксидантної активності Aβ (Celsi et al., 2004).
Підвищена активність СОД також може бути ефективною з терапевтичної точки зору, забезпечуючи захист від хронічного окислювального стресу, спричиненого нейроповедінковим порушенням, що виникає в організмі при старінні. У зв'язку з цим у мишей з генетичною надмірною експресією СОД не спостерігалося спричиненого старінням зниження здатності до навчання і пам'яті, яке спостерігалося у мишей дикого типу (Levin, 2005).
Крім доведених важливих переваг СОД у патогенезі ХА, пов'язаного з окислювальним стресом, TetraSOD® має унікальну характеристику, яка може сприяти зниженню симптомів ХА: інгібіторну активність холінестерази по відношенню до ацетилхолінестерази (AChE), на підставі результатів попередніх досліджень із застосуванням TetraSOD® (неопублікованих даних) та зареєстрованих результатів, отриманих при застосуванні мікроводорості Тетраселміс Чуі (Custodio et al., 2012).
AChE є важливим компонентом холінергічних синапсів у центральній нервовій системі ссавців і колокалізується з відкладеннями пептиду Aβ в мозку осіб з ХА. Повідомлялося, що AChE прискорює утворення амілоїдів, тим самим діє як потужний амілоїд-стимулюючий фактор (InestАФКa et al., 1996).
69783604a59c5
На закінчення можна сказати, що TetraSOD® може захистити клітини старіючого мозку від загибелі нейронів, спричиненої окислювальним стресом, не тільки діючи як метал у хелатній формі і маючи потужні антиоксидантні властивості, але й також інгібуючи активність AChE без будь-якої токсичності. У той час як зниження активності СОД викликає нейронну та судинну патологію в осіб з ХА, підвищення активності СОД за рахунок споживання TetraSOD® може бути ефективним для досягнення терапевтичного ефекту.
Page Copyright
© Copyright 2024 Kleemed Ukraine LLC - All rights reserved.
